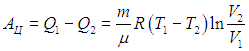Энтропия. Второе начало термодинамики
2.3.1. Обратимые и круговые процессы
Обратимым процессом называется такой процесс, который может быть проведен в обратном направлении таким образом, что система будет проходить через те же термодинамические состояния, что и при прямом процессе, но в обратной последовательности. Обратимым может быть только равновесный процесс.
Обратимый процесс обладает следующим свойством: если при прямом ходе на каком-то элементарном участке система получает тепло dQ и совершает работу dA, то при обратном ходе на том же участке система отдает тепло dQ" = dQ и над ней совершается работа dA" = dA. По этой причине после протекания обратимого процесса в одном, а затем в обратном направлении и возвращения системы в первоначальное состояние в окружающих систему телах не должно произойти никаких изменений.
Круговым процессом (циклом) называется такой процесс, при котором система после ряда изменений возвращается в исходное состояние. На графике цикл изображается замкнутой кривой (Рис. 2.3.1).
Рис. 2.3.1. Круговой термодинамический процесс
Работа, совершаемая при круговом процессе, численно равна площади, охватываемой кривой. Действительно, работа на участке 1-2 положительна и численно равна площади, отмеченной наклоненной вправо штриховкой. Работа на участке 2-1 отрицательна и численно равна площади, отмеченной наклоненной влево штриховкой. Следовательно, работа за цикл численно равна площади, охватываемой кривой.
После совершения цикла система возвращается в исходное состояние.
2.3.2. Коэффициент полезного
действия тепловой машины
Всякий двигатель представляет собой систему, совершающую многократно некоторый круговой процесс (цикл). Пусть в ходе цикла рабочее вещество (например, газ) сначала расширяется до объема V 2 , а затем снова сжимается до первоначального объема V 1 (Рис. 2.3.2).

Рис. 2.3.2. К расчету кпд тепловой машины
Чтобы работа за цикл была больше нуля, давление (а, следовательно, и температура) в процессе расширения должно быть больше, чем при сжатии. Для этого рабочему веществу нужно в ходе расширения сообщать, а в ходе сжатия отнимать от него тепло.
Напишем первое начало термодинамики для обеих частей цикла. При расширении внутренняя энергия изменяется от значения U 1 до U 2 , при этом система получает тепло Q 1 и совершает работу А 1 . Поэтому выполняется:
При сжатии система совершает работу А 2 и отдает тепло Q 2 , что равносильно получению тепла Q 2 . Следовательно,
Складывая уравнения (2.3.1) и (2.3.2), получаем:
Поскольку А 1 + А 2 есть полная работа А, совершаемая системой за цикл, можно записать:
Периодически действующий двигатель, совершающий работу за счет получаемого извне тепла, называется тепловой машиной .
Первое начало термодинамики иногда формулируют так: периодически действующий вечный двигатель (перпетуум мобиле) первого рода, совершающий работу в большем количестве, чем он получает энергии извне, невозможен .
Как следует из (2.3.4), не все получаемое извне тепло Q 1 используется для получения полезной работы. Для того, чтобы двигатель работал циклами, часть тепла Q 2 должна быть возвращена во внешнюю среду и, следовательно, не используется по назначению. Очевидно, что чем полнее тепловая машина превращает получаемое извне тепло Q 1 в полезную работу А, тем эта машина выгоднее. Поэтому тепловую машину принято характеризовать коэффициентом полезного действия (КПД), который определяется как отношение совершаемой за цикл работы к получаемому за цикл количеству тепла Q 1:
Из определения КПД следует, что он не может быть больше единицы.
2.3.3. Второе начало термодинамики
Второе начало термодинамики, как и первое, может быть сформулировано несколькими способами. В наиболее очевидной формулировке второе начало гласит, что:
невозможен самопроизвольный переход тепла от тела, менее нагретого, к телу, более нагретому. Более строго, невозможны такие процессы, единственным конечным результатом которых был бы переход тепла от тела, менее нагретого, к телу, более нагретому.
Еще одна формулировка: невозможны такие процессы, единственным конечным результатом которых явилось бы отнятие от некоторого тела определенного количества тепла и превращение этого тепла в работу полностью.
Работа может быть полностью превращена в тепло, например, посредством трения, обратное неверно.
2.3.4. Цикл Карно
Предположим, что какое-либо тело может вступать в теплообмен с двумя тепловыми резервуарами, имеющими температуры Т 1 и Т 2 и обладающими бесконечно большой теплоемкостью. Это означает, что получение или отдача этими резервуарами конечного количества тепла не изменяет их температуры. Выясним, какой обратимый цикл может совершать тело в таких условиях.
Рассматриваемый цикл может состоять как из процессов, в ходе которых тело обменивается теплом с резервуарами, так и из процессов, не сопровождающихся теплообменом с окружающей средой, т.е. происходящих адиабатически.
Процесс, сопровождающийся обменом тепла с резервуарами, может быть обратимым только в том случае, если в ходе этого процесса температура тела будет равна температуре соответствующего резервуара. Это - изотермический процесс, протекающий при температуре резервуара.
Обратимый цикл, совершаемый телом (или системой), вступающим в теплообмен с двумя тепловыми резервуарами бесконечно большой емкости, будет состоять из двух изотер (при температурах резервуаров) и двух адиабат. Это - цикл Карно .
Рассмотрим, как может быть осуществлен цикл Карно с газом в качестве рабочего вещества. Поместим газ в цилиндр, закрытый плотно пригнанным поршнем. Пусть стенки и поршень сделаны из непроводящих тепло материалов, дно цилиндра, напротив, изготовлено из материала с высокой теплопроводностью. Теплоемкость цилиндра и поршня считается бесконечно малой.
Пусть первоначально поршень занимает положение, отвечающее объему V 1 и температуре газа Т 1 . Поставим цилиндр на резервуар, имеющий температуру Т 1 , и предоставим газу возможность очень медленно расширяться до объема V 2 . При этом газ получит от резервуара тепло Q 1 (Рис. 2.3.3).

Рис. 2.3.3. Тепловая машина, работающая по циклу Карно
Затем снимем цилиндр с резервуара, закроем дно теплоизолирующей крышкой и позволим газу расширяться адиабатически до тех пор, пока его температура не упадет до значения Т 2 . Объем газа в результате станет равным V 3 . Убрав теплоизолирующую крышку, поставим цилиндр на резервуар, имеющий температуру Т 2 и сожмем газ изотермически до такого объема V 4 , чтобы при последующем адиабатическом сжатии при достижении температуры Т 1 объем получил значение V 1 (иначе цикл не замкнется). Наконец, снимем цилиндр с резервуара, закроем дно теплоизолирующей крышкой и, сжимая газ адиабатически, приведем его в первоначальное состояние (температура Т 1 , объем V 1).
Если газ идеальный, соответствующий цикл на (р-V) диаграмме имеет вид, показанный на Рис. 2.3.4.

Рис. 2.3.4. (р-V) диаграмма цикла Карно
2.3.5. КПД цикла Карно для идеального газа
Рассмотрим цикл Карно для идеального газа. КПД тепловой машины равен:
где Q 1 - тепло, получаемое за цикл от нагревателя, Q 2 - тепло, отдаваемое за цикл холодильнику.
При изотермическом процессе внутренняя энергия идеального газа остается постоянной. Поэтому количество полученного газом тепла Q 1 равно работе А 12 , совершаемой газом при переходе из состояния 1 в состояние 2 (Рис. 2.3.4). Эту работу можно рассчитать так:
Используя уравнение Клапейрона-Менделеева, получим:
где m - масса идеального газа а тепловой машине.
Количество отдаваемого холодильнику тепла Q 2 равно работе А 34 , затрачиваемой на сжатие газа при переводе его из состояния 3 в состояние 4. Эта работа равна:
Для того, чтобы цикл был замкнутым, нужно, чтобы состояния 4 и 1 лежали на одной и той же адиабате. Отсюда с помощью (2.1.68) можно получить:
Аналогично, поскольку состояния 2 и 3 лежат на одной и той же адиабате, выполняется:
Деля (2.3.11) на (2.3.10), приходим к условию замкнутости цикла:
Окончательно, учитывая условие (2.3.12), для КПД тепловой машины, работающей по циклу Карно для идеального газа, получаем:
Следовательно, КПД цикла Карно для идеального газа оказывается зависящим только от температуры нагревателя и холодильника.
Даже для наилучшей тепловой машины, работающей по циклу Карно, КПД всегда значительно меньше единицы. Если, например, температура нагревателя Т 1 = 373К (температура кипения воды), а температура холодильника Т 2 = 293К (комнатная температура), то η = 22%. И этот КПД является верхним (и недостижимым) пределом. В реальных машинах, например, на паровозах, редко превосходил 10%.
2.3.6. Энтропия
Обратим внимание на те изменения, которые претерпело рабочее тело в процессе кругового цикла Карно. Из исходного состояния 1 (давление р 1 , температура Т 1) рабочее тело путем последовательного проведения изотермического и адиабатического расширений перешло в состояние 3, когда оно приняло температуру холодильника Т 2 . Это изменение состояния произошло за счет тепла Q 1 , доставленного рабочему телу нагревателем. Обратный переход рабочего тела из состояния 3 в исходное состояние 1 был осуществлен двумя последовательно проведенными изотермическим и адиабатическим сжатиями тела. Выделившееся при этом возвращении в исходное состояние количество тепла равно Q 2 , причем Q 2 < Q 1 . Таким образом, оказывается, что обратимый переход одного и того же тела из состояния 1 → 3 и обратный переход 3 → 1 сопровождаются неодинаковыми количествами поглощенного и выделенного тепла. Очевидно, что это связано с тем, что оба перехода были проведены различными путями: в одном случае (1 → 3) процесс расширения происходил при давлении более высоком, чем процессы сжатия в другом (3 → 1). Ясно, что если бы мы осуществили переход 3 → 1 тем же путем, что и прямой, т.е. по кривой 3 → 2 → 1, а не по кривой 3 → 4 → 1 (), то количество тепла, затраченного при прямом переходе, в точности равнялось бы количеству тепла, выделившемуся при обратном переходе.
Отсюда следует важный вывод: количество тепла, которое должно быть доставлено телу или отнято у него при переходе из одного состояния в другое, не определяется однозначно начальным и конечным состояниями, но существенно зависит от способа осуществления этого перехода.
Однако, хотя сами количества тепла - Q 1 , доставленного рабочему телу нагревателем при температуре Т 1 , и Q 2 , переданное рабочим телом холодильнику при температуре Т 2 , не равны между собой, то, как следует из сопоставления формул (), () и (), отношения этих теплот к тем температурам, при которых они были поглощены или отданы, численно равны между собой (но имеют противоположные знаки):
Отношение называют, следуя Лоренцу, приведенной теплотой . Из (2.3.15) следует, что приведенные теплоты, полученные и отданные рабочим телом при круговом процессе, равны между собой.
Обобщим данный результат. Любое изменение состояния тела или системы тел в общем случае можно представить как результат бесконечно большого числа бесконечно малых изменений. При каждом таком бесконечно малом изменении система либо поглощает, либо выделяет бесконечно малое количество тепла dQ (если процесс не адиабатический). Пусть dQ > 0, когда система поглощает тепло.где dQ - количество тепла, отнятое от тела М при температуре Т, dQ" - количество тепла, переданное резервуару с температурой Т 1 .
Если Т 1 < T, резервуар играет роль холодильника, а тело М - нагревателя, и наоборот.
После того, как телом М будет завершен круговой процесс, общее количествo теплоты, потерянное телом, как следует из (2.3.17), должно быть равно величине . Поскольку теплоемкость резервуара велика и его температура остается постоянной, эта величина будет равна: .
Процесс, совершенный телом, - круговой. Поэтому оно в конце концов не испытало никаких изменений. Если бы интеграл (2.3.16) оказался положительным, то это означало бы, что потерянное телом количество тепла целиком превратилось в работу, тогда как тело М своего состояния не изменило. Однако это противоречит второму началу термодинамики. Значит, предположение о том, что , несостоятельно. Аналогично можно показать, что указанный интеграл не может быть отрицательным. Но если он не может быть ни положительным, ни отрицательным, то это означает, что для обратимых круговых процессов выполняется:
Энтропия изолированной системы может только возрастать (если в системе протекает необратимый процесс), или оставаться постоянной в случае обратимого процесса.
Нернстом доказана теорема (иногда называемая третьим началом термодинамики), согласно которой при стремлении абсолютной температуры к нулю энтропия любого тела также стремится к нулю:
Тогда энтропию состояния тела при температуре Т можно вычислить так.
В термодинамике цикл Карно́ или процесс Карно - это обратимый круговой процесс, состоящий из двух адиабатических и двух изотермических процессов . В процессе Карно термодинамическая система выполняет механическую работу и обменивается теплотой с двумя тепловыми резервуарами, имеющими постоянные, но различающиеся температуры. Резервуар с более высокой температурой называется нагревателем, а с более низкой температурой - холодильником
Цикл Карно назван в честь французского учёного и инженера Сади Карно, который впервые его описал в своём сочинении «О движущей силе огня и о машинах, способных развивать эту силу» в 1824 году
Поскольку обратимые процессы могут осуществляться лишь с бесконечно малой скоростью, мощность тепловой машины в цикле Карно равна нулю. Мощность реальных тепловых машин не может быть равна нулю, поэтому реальные процессы могут приближаться к идеальному обратимому процессу Карно только с большей или меньшей степенью точности. В цикле Карно тепловая машина преобразует теплоту в работу с максимально возможным коэффициентом полезного действия из всех тепловых машин, у которых максимальная и минимальная температуры в рабочем цикле совпадают соответственно с температурами нагревателя и холодильника в цикле Карно.
Описание цикла Карно
Цикл Карно в координатах T-S
Пусть тепловая машина состоит из нагревателя с температурой , холодильника с температурой и рабочего тела.
Цикл Карно состоит из четырёх обратимых стадий, две из которых осуществляются при постоянной температуре (изотермически), а две - при постоянной энтропии (адиабатически). Поэтому цикл Карно удобно представить в координатах T (температура) и S (энтропия).
1. Изотермическое расширение (на рис. 1 - процесс A→Б). В начале процесса рабочее тело имеет температуру , то есть температуру нагревателя. Затем тело приводится в контакт с нагревателем, который изотермически (при постоянной температуре) передаёт ему количество теплоты . При этом объём рабочего тела увеличивается, оно совершает механическую работу, а его энтропия возрастает.
2. Адиабатическое расширение (на рис. 1 - процесс Б→В). Рабочее тело отсоединяется от нагревателя и продолжает расширяться без теплообмена с окружающей средой. При этом температура тела уменьшается до температуры холодильника , тело совершает механическую работу, а энтропия остаётся постоянной.
3. Изотермическое сжатие (на рис. 1 - процесс В→Г). Рабочее тело, имеющее температуру , приводится в контакт с холодильником и начинает изотермически сжиматься под действием внешней силы, отдавая холодильнику количество теплоты . Над телом совершается работа, его энтропия уменьшается.
4. Адиабатическое сжатие (на рис. 1 - процесс Г→А). Рабочее тело отсоединяется от холодильника и сжимается под действием внешней силы без теплообмена с окружающей средой. При этом его температура увеличивается до температуры нагревателя, над телом совершается работа, его энтропия остаётся постоянной.
Кпд тепловой машины Карно
Количество теплоты, полученное рабочим телом от нагревателя при изотермическом расширении, равно
Аналогично, при изотермическом сжатии рабочее тело отдаёт холодильнику
Отсюда коэффициент полезного действия тепловой машины Карно равен
![]() .
.
Второе начало термодинамики: Невозможно построить периодически действующую тепловую машину, которая бы всю подводимую к ней теплоту превращала в работу, т.е. всегда .
Французский инженер Сади Карно предложил идеальный цикл, который даёт максимальное значение КПД. Этот цикл состоит из двух изотерм и двух адиабат и носит название цикла Карно .
| - изотермическое расширение при , - адиабатическое расширение , - изотермическое сжатие при , - адиабатическое сжатие . |
 Рис. 2.2 Цикл Карно в координатах (P, V).
Рис. 2.2 Цикл Карно в координатах (P, V).
Вычислим КПД цикла Карно для идеального газа. При изотермическом процессе внутренняя энергия идеального газа остаётся постоянной. Поэтому количество полученной газом теплоты равно работе , совершаемой газом при переходе из состояния 1 в состояние 2 (рис. 2.2). Эта работа равна ![]() где – масса идеального газа в тепловой машине.
где – масса идеального газа в тепловой машине.
Количество отдаваемой холодильнику теплоты равно работе , затраченной на сжатие газа при переходе его из состояния 3 в состояние 4. Эта работа равна![]() .
.
Для того, чтобы цикл был замкнутым, состояние 1 и 4 должны лежать на одной и той же адиабате. Отсюда вытекает условие:
![]() .
.
Аналогично для состояний 2 и 3 справедливо условие:
![]() .
.
Разделив одно соотношение на другое, приходим к условию замкнутости цикла :
Подставляя и в выражение для КПД, получим:
![]() . (2.2)
. (2.2)
В результате получим формулу для КПД цикла Карно:
где - температура нагревателя, - температура холодильника. КПД цикла Карно является максимальным КПД из всех возможных циклов, осуществляемых в данных температурных интервалах и .
Соотношение (2.2) составляет содержание теоремы Карно для обратимого цикла :
![]() .
.
Для необратимого цикла теорема Карно принимает вид:
![]() .
.
В общем случае можно объединить эти две записи теоремы Карно :
![]() . (2.3)
. (2.3)
Преобразуем (2.3) следующим образом:
В результате получим
Для обратимого цикла Карно: ,
для необратимого цикла Карно: .
Тогда в случае произвольного обратимого цикла можно получить:
а в случае произвольного необратимого цикла:
Соотношение (2.4) показывает, что величина, стоящая под знаком интеграла, является функцией состояния. Эта функция состояния обозначается буквой S и называется энтропией . Наряду с внутренней энергией U энтропия S играет важную роль в термодинамике.
Конец работы -
Эта тема принадлежит разделу:
Основные положения молекулярно-кинетической теории. Масса и размер молекул
М к т изучает свойства вещества давление температуру и так далее как суммарный результат действий молекул при этом пользуется статическим..
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ:
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Все темы данного раздела:
Основные положения молекулярно-кинетической теории
1. Все вещества состоят из мельчайших частиц - атомов и молекул.
2. Молекулы и атомы любого вещества находятся в непрерывном хаотическом движении, которое называется тепловым движением
Масса и размеры молекул
Для характеристики масс атомов и молекул применяются следующие величины:
Атомная масса – масса атома вещества, выраженная в а.е.м.
Молекулярная масса – масса
Термодинамические параметры и процессы. Урав-е сост-я идеального газа
Для описания состояния термодинамической системы вводятся физические величины, которые называются термодинамическими параметрами или параметрами состояния системы. Обычно в качестве термодин
Основное ур-е молекулярно-кинетической теории гага
1) Молекулы газа движутся только вдоль трех взаимно перпендикулярных направлений. Если в сосуде содержится N молекул, то в любой момент времени вдоль каждой из осей координат будет двигаться
Закон равномерного распределения энергии по степеням свободы. Внутренняя энергия ИГ
Числом степеней свободы i системы называется количество независимых величин, с помощью которых может быть задано положение системы. Так, положение в пространстве материальной точки полностью
Максвелловское распределение энергии по степеням свободы молекул газа. Внутренняя энергия идеального газа
В случае идеального газа число молекул в единице объема, имеющих значение компоненты скорости в интервале от vx до vx + dvx может быть представ
Характерные скорости молекул газа. Опыт Штерна
1.-наиболее вероятная скорость молекул
Больцмановское распределение частиц газа по потенциальной энергии. Распределение Максвелла-Больцмана
Если газ находится во внешнем силовом поле, то частицы газа обладают потенциальной энергией eп. Распределение молекул идеального газа по высоте в однородном гравитационном поле.
Средняя длина свободного пробега молекул газа. Понятие о вакууме
Под средней длиной свободного пробега понимают среднее расстояние, которое проходит молекула между двумя последовательными соударениями.
За секунду молекула в среднем проходит расстояние,
Явление переноса: теплопроводность ИГ
Явления переноса в газах. Общие закономерности.
Беспорядочность теплового движения молекул газа, непрерывные соударения между ними приводят к постоянному перемешиванию частиц и изменению и
Диффузия и внутреннее трение в идеальном газе
Явление переноса - диффузия - заключается в самопроизвольном взаимном проникновении и перемешивании частиц двух соприкасающихся газов, жидкостей и даже твердых тел. При этом различают самодиффузию
Первое начало термодинамики. Теплоемкость ИГ. Работа газа при изменении его объема
Первое начало термодинамики:
Количество теплоты, сообщённое газу, идёт на приращение внутренней энергии газа и на совершенигазом работы над внешними телами.
Термодинамика изохорического процесса: V=const
Рассмотрим закон, описывающий этот процесс, и его график в координатах (P,V). Этот закон является частным случаем уравнения Менделеева-Клапейрона (уравнения состояния идеального газа)
Термодинамика изотермического процесса: T=const
Приведем закон, описывающий этот процесс, и его график в координатах (P,V). Рассмотрев два состояния идеального газа 1 и 2, получим
Термодинамика адиабатического процесса: dQ=0
Адиабатический процесс - это процесс, протекающий без теплообмена с окружающей средой.
Поскольку dQ = 0, то первое начало термодинамики принимает вид:
Политропические процессы
Политропическими процессами называются процессы, при которых теплоемкость газа остается постоянной.
Найдем уравнение состояния идеального газа при политропическом процессе, т.е. уравнение
Энтропия и 2-е начало трмодинамики
Энтропия – это такая функция состояния, дифференциал которой определяется отношением:
Реальный газ. Уравнение Ван-дер-Ваальса и его анализ. Критическое состояние и его параметры
Реальный газ - газ, который не описывается уравнением состояния идеального газа Клапейрона - Менделеева.
Зависимости между его параметрами показывают, что молекулы в реальном газе взаимоде
Лекции по физике. Молекулярная физика и основы термодинамики Второе начало термодинамики. Тепловые двигатели. Энтропия. Цикл Карно Обратимые и необратимые процессы Обратимым называют процесс, допускающий возможность возвращения системы в первоначальное состояние без того, чтобы в окружающей среде остались какие-либо изменения Обратимым может быть лишь равновесный процесс, но не всякий равновесный процесс обратим 2 Обратимые и необратимые процессы Пример. Рассмотрим систему из газа, находящегося в цилиндре под поршнем, на котором установлен груз Уберём груз. Газ расширится. Чтобы вернуть газ в исходное положение надо поднять груз на высоту h, совершив работу A=Mgh, и положить его на поршень Процесс не обратимый М М М М h 3 Обратимые и необратимые процессы Разобьём груз на две равных части Теперь, чтобы расширить и сжать газ в исходное состояние, надо затратить работу A=Mgh/2 Если мы будем производить перемещение поршня на бесконечно малые расстояния, то получим обратимый процесс М/2 h М/2 М/2 М/2 М/2 М/2 М/2 4 Обратимые и необратимые процессы Пример равновесного необратимого процесса – теплообмен Компенсацией за осуществление необратимых круговых процессов является перевод энергии из одной формы в другую. В этом проявляется неэквивалентность различных форм энергии Тепловая энергия оказывается менее ценным видом энергии, чем другие 5 Второе начало термодинамики Второе начало термодинамики констатирует неэквивалентность различных видов энергии. Оно постулирует направление протекания тепловых процессов Формулировка Клаузиуса: Теплота не может самопроизвольно переходить от тела менее нагретого к более нагретому 6 Второе начало термодинамики Формулировка Томсона. Невозможен круговой процесс, единственным результатом которого было бы совершение работы за счёт охлаждения теплового резервуара Устройство, которое позволяло бы осуществлять этот процесс, называется вечным двигателем второго рода 7 Второе начало термодинамики Второе начало Т.Д. накладывает запрет на вечный двигатель второго рода Из второго начала Т.Д. можно получить множество конкретных результатов с помощью метода циклов и метода термодинамических функций 8 Тепловые двигатели Тепловой двигатель – это устройство, в котором совершается циклический Т.Д. процесс В любом тепловом двигателе тепло передаётся от нагревателя к рабочему телу, а затем к холодильнику. При этом совершается полезная работа Нагреватель Q1 Рабочее тело Q2 Холодильник A 9 Тепловые двигатели 10 Метод циклов В циклическом процессе U=0 Q=A=Q1-Q2 При переходе 12 работа совершается системой, а при переходе 21 над системой При переходе 1"2‘ тепло передаётся системе, а при переходе 2"1" от системы КПД теплового двигателя =A/Q1=(Q1-Q2)/Q1 P Адиабаты Q1 2" 1 1" Q2 2 V 11 Цикл Карно Цикл Карно состоит из двух изотерм и двух адиабат Теплоёмкости в адиабатическом и изотермическом процессах не зависят от рабочего тела, поэтому их рассмотрение позволяет выявить ряд общих закономерностей P Адиабаты Изотермы Q1 Т1 Q2 Т2 V 12 Цикл Карно Первая теорема Карно: Коэффициент полезного действия тепловой машины, работающей по циклу Карно, зависит только от температур нагревателя и холодильника и не зависит от устройства машины и типа рабочего тела 13 Цикл Карно Для идеального газа: Q1=RT1ln(V2/V1) Q2=RT2ln(V4/V3) A=Q1-Q2=RT1ln(V2/V1)RT2ln(V3/V4) =A/Q1=/RT1ln(V2/V1) Из уравнения адиабаты: TV-1=const P V1 Q1 Т1 V2 Q2 V4 Т2 V3 V 14 Цикл Карно T1V1-1= T2V4-1 и T1V2-1= T2V3-1 V2/V1=V3/V4 =(T1-T2)/T1=1-T2/T1 Для повышения КПД надо повышать температуру нагревателя и понижать температуру холодильника =(Q1-Q2)Q1=(T1-T2)/T1 Q1/T1=Q2/T2 Величина Q/T называется приведённой теплотой 15 Цикл Карно Вторая теорема Карно: КПД любого цикла не может быть больше, чем КПД цикла Карно - =1Т2/Т1, где под Т1 понимается максимальная, а под Т2 минимальная температура P V 16 Энтропия Рассмотрим произвольный равновесный цикл. Аппроксимируем его малыми циклами Карно Для каждого цикла К можно записать: Q1i/T1i-Q2i/T2i=0 Просуммировав по всем циклам получим: Qk/Tk=0 Т.о. получаем, что dQ/T – дифференциал некоторой Т.Д. функции Назовём эту функцию энтропией P V 17 Энтропия Энтропия – это такая функция состояния, дифференциал которой связан с элементарным тепловым эффектом в обратимом процессе соотношением: dQ=TdS () Энтропия S имеет размерность теплоёмкости С учётом () первое начало Т.Д. можно выразить как: TdS=dU+PdV Отсюда, зная термическое и калорическое уравнения, состояния можно найти зависимость энтропии от Т.Д. параметров 18 Энтропия Найдём энтропию идеального газа Из dU=cVdT и P/T=R/V следует что: dS=cVdT/T+RdV/V S(T,V)=cVlnT+RlnV при cV=const Можно S выразить через T и P: S(T,P)=cPlnT-RlnP 19 Энтропия Определение энтропии через теплоту встречает одну трудность. В точке Т=0 интеграл dQ/T может расходиться Эта неопределённость устраняется постулатом Нернста, называемым иногда третьим началом термодинамики 20 Постулат Нернста Постулат Нернста сводится к двум утверждениям: 1. 2. При приближении к абсолютному нулю энтропия стремится к определённому конечному пределу. Можно положить S(Т=0)=0 Все равновесные процессы при Т=0 происходят без изменения энтропии. В частности, при Т=0 S не зависит от объёма 21 Статистическая интерпретация энтропии Вероятность состояния пропорциональна его статистическому весу Ω, т.е. числу микроскопических способов, которым может быть осуществлено данное макросостояние Разобьём некоторую Т.Д. систему на две подсистемы, которые находятся в состояниях со стат. весами Ω1 и Ω2 Число способов, которыми может реализоваться данное состояние системы: Ω=Ω1Ω2 22 Статистическая интерпретация энтропии Т.о. логарифм стат. веса является аддитивной функцией состояния системы: lnΩ=lnΩ1+lnΩ2 Энтропия системы: S=klnΩ () где k – постоянная Больцмана Формула () называется формулой Больцмана 23 Статистическая интерпретация энтропии Т.к. равновесным состоянием является состояние с наибольшим стат. весом (и наибольшей энтропией), то можно заключить, что при протекании необратимых процессов энтропия изолированной системы возрастает Энтропия системы, находящейся в равновесном состоянии, максимальна 24 Статистическая интерпретация энтропии При протекании обратимых процессов энтропия изолированной системы остаётся постоянной Энтропия равновесной системы не остаётся строго постоянной она претерпевает флуктуации Второй закон термодинамики, иногда называемый законом возрастания энтропии, утверждает, что энтропия изолированной системы может только возрастать либо оставаться неизменной: S≥0 25 26
Для работы любой тепловой машины по замкнутому циклу необходима внешняя среда, которую условно можно представить себе как два тела - нагреватель Т mах, и холодильник , находящийся при температуре T min (T min < Т mах ). Предполагается, что при контакте с нашей системой температуры нагревателя и холодильника не меняются. При контакте с нагревателем система получает тепло, при контакте с холодильником - отдает его.
В термодинамике существует теорема Карно (рис. 5.2):
Рис. 5.2. Леонар Сади Карно (французский физик и военный инженер)
|
При заданных температурах нагревателя и холодильника максимально возможный КПД тепловой машины не зависит от природы рабочего тела машины и определяется формулой
|
Реализация максимально возможного КПД достигается в так называемом цикле Карно , когда идеальный газ проходит замкнутый цикл, составленный из двух адиабат и двух изотерм (рис. 5.3).

Рис. 5.3. Цикл Карно (обходится по часовой стрелке) - комбинация двух изотерм 1 - 2, 3 - 4 и двух адиабат 2 - 3 и 4 - 1 ; теплообмен со средой осуществляется на изотермических участках цикла: на участке 1 - 2 газ получает теплоту Q 1 , а на участке 3 - 4 отдает теплоту Q 2
Убедимся, что показанный замкнутый процесс действительно имеет КПД, соответствующий формуле (5.5). Температура системы равна T 1 в точках 1, 2 и T 2 в точках 3, 4 . Значения остальных термодинамических параметров (р, V) будут иметь в качестве индекса номер соответствующей точки на диаграмме. Нам надо вычислить количества полученной Q 1 , и отданной Q 2 теплоты, найти совершенную газом работу А Ц = Q 1 – Q 2 и определить КПД цикла. Сразу заметим, что на участках 2-3 и 4-1 система не обменивается теплом с внешней средой. Следовательно, теплоту Q 1 газ получает на участке 1-2, а теплоту Q 2 отдает на участке 3-4. Рассмотрим подробнее различные участки цикла.
Изотерма 1 -2. На этом участке газ находится в контакте с нагревателем и происходит изотермическое расширение от объема V 1 до объема V 2 . Температура Т 1 не меняется, следовательно, не изменяется внутренняя энергия, а вся полученная теплота расходуется на совершение газом работы:
![]()
Величину работы газа при изотермическом процессе мы уже вычисляли ранее, так что с учетом формулы (2.13) находим
находим
|
|
Адиабата 2 -3. Здесь система отсоединяется от нагревателя и не обменивается теплом с внешней средой: Q 23 = 0 . Газ продолжает расширяться, но уже адиабатно. Работа совершается за счет внутренней энергии газа, и его температура падает до значения Т 2 . На этом участке цикла нам нужна информация, доставляемая уравнением адиабаты :
|
|
Изотерма 3 -4. Система подключается к холодильнику, и газ начинает сжиматься. Внутренняя энергия остается неизменной, над газом совершается работа (А 34 < 0 ), а выделяющееся
![]()
передается холодильнику. Имеем аналогично (5.6)
|
|
Адиабата 4 -1. Система отключена от внешней среды и продолжает сжиматься изотермически, что приводит к повышению ее температуры до Т 1 . В конечном итоге система возвращается в первоначальное состояние. Поскольку точки 4 и 1 лежат на адиабате, получаем связь объемов и температур, аналогичную (5.7):
|
|
Из уравнений (5.7) и (5.9) находим отношения объемов

откуда следует, что
Поэтому отдаваемую холодильнику теплоту Q 2 (см. уравнение (5.8)) можно записать как
|
|
Используя выражение (5.6) для теплоты, полученной системой, находим совершенную в ходе цикла работу
|
|
Из проведенного анализа следует также, что максимальная температура в цикле равна Т mах = Т 1 , а минимальная - Т min = Т 2 . Если разделить (5.12) на (5.6), то немедленно получим выражение (5.5) для КПД цикла Карно, из которого выпадают все параметры, кроме температур холодильника и нагревателя.
Пример 1. Котел тепловой станции работает при температуре около t 1 = 550 °С . Отработанное тепло отводится к реке при температуре около t 2 = 20 °С . Найдем максимально возможный КПД этой станции (рис. 5.4).

Рис. 5.4. Схема работы тепловой машины Карно
Поскольку в формуле для КПД цикла Карно используются абсолютные температуры, надо перейти от шкалы Цельсия к шкале Кельвина: Т 1 = 550 + 273 = 823 К , Т 2 = 20 + 273 = 293 К . Теперь находим КПД тепловой станции:
![]()
Конечно, реальный КПД станции заметно ниже.
Если цикл Карно осуществить в обратном направлении, то есть против часовой стрелки на рис. 5.2, то для определения эффективности холодильной установки надо использовать формулы (5.3), (5.4) и выражения (5.6), (5.11). Получаем тогда
|
|
Печально, но чем ниже температура внешней среды Т 1 , тем меньше мы нуждаемся в холодильнике, и тем эффективнее он работает.

Рис. 5.5. Схема работы холодильной установки
Приведем численный пример. Если кондиционер поддерживает в комнате температуру t 2 = 20 °С , а температура наружного воздуха равна t 1 = 30 °С , то для холодильного коэффициента имеем

а для КПД холодильника

Конечно, на самом деле температура тепловыделяющего элемента больше наружной температуры на 20–30 градусов, так что разность температур может достигать 30–40 градусов, что приводит к значениям

Напомним, что речь идет об идеальных установках, работающих по циклу Карно. Реальный типичный кондиционер потребляет мощность 750 Вт , перекачивая за час около 5 МДж тепловой энергии. Это значит, что за секунду кондиционер совершает работу А = 750 Дж и отнимает у воздуха в комнате теплоту

Отсюда находим
Мы видим, что реальный кондиционер гораздо менее эффективен, нежели идеальный холодильник Карно.
Пример 2. Пусть в домашнем холодильнике поддерживается температура t 2 = –3 °С (Т 2 = 270 К ), а температура в кухне равна t 1 = 27 °С (T 1 = 300 К ). Пусть далее мотор холодильника потребляет мощность N = 200 Вт . Предполагая, что холодильник работает по циклу Карно и что тепловыделяющий элемент имеет температуру окружающего воздуха, определим мощность потока тепловой энергии, перекачиваемой из камеры холодильника в кухню.
За время t мотор совершит работу
КПД холодильника равен

откуда находим количество теплоты, поступающее в кухню в единицу времени:

Обратите внимание, что холодильник работает как весьма эффективный обогреватель помещения. Надо только оплачивать потребляемую мотором мощность 200 Вт , а в кухню поступит в 10 раз большая энергия, 90 % которой перекачивается из камеры холодильника (90 % - КПД холодильника в этом примере). Любопытно, что если бы вместо холодильника был включен обогреватель той же мощности, то он нагревал бы помещение в 10 раз слабее.
Наши численные оценки можно рассматривать как пример теплового загрязнения окружающей среды, свойственного технической цивилизации.
Дополнительная информация
http://eqworld.ipmnet.ru/ru/library/physics/thermodynamics.htm - Я. де Бур Введение в молекулярную физику и термодинамику, Изд. ИЛ, 1962 г. - стр. 202–205, ч. 2, гл. 2, § 10: описан процесс ожижения газа Клода - Гейландта.